#6월 초 미국 제약사 브리스톨-마이어스 스퀴브(BMS)는 독일 바이오엔테크의 항암제에 최대 111억 달러를 지불한다고 발표했다. 이 기술은 바이오엔테크가 2023년 중국 제약사 바이오테우스(普米斯)로부터 라이선스를 취득한 항암제 기술이다.
과거 다국적 제약사 약품을 베끼기에만 급급했던 중국 바이오 제약회사들이 '모방자'에서 '혁신자'로 변신 중이다. 중국 경제매체 차이신은 최근 글로벌 제약 업계에서는 "중국 바이오 신약의 '딥시크 모먼트'가 왔다"는 말까지 나온다고 보도했다. 중국 인공지능(AI) 스타트업 '딥시크'의 기술력이 업계에 충격을 안긴 이른바 '딥시크 모먼트'가 바이오 신약 방면에서도 재현될 것이란 이야기다.
해외 라이선스로 71조 ‘잭팟’...中신약 굴기
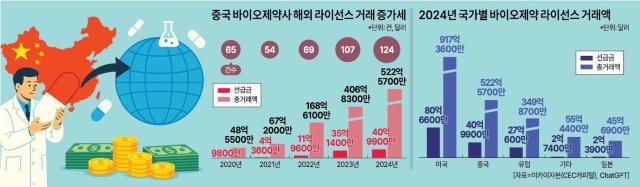
지난해 중국 의약품의 해외 라이선스 아웃(기술 이전) 거래 건수만 124건, 신약 기술이나 파이프라인의 해외 라이선스 계약 건수는 152건이다.
신약 파이프라인은 신약이 될 후보물질을 발굴하고 임상 시험 단계별로 수행하는 전체 프로젝트를 일컫는 말이다. 보통 잠재력이 인정되는 유망한 신약 파이프라인은 임상 전 단계나 임상 초기 단계에서 다른 회사에 기술 이전된다.
백서는 “중국 제약사의 기술 이전 건수는 미국, 유럽보다 적지만, 전체 거래액이나 선급금 액수는 이미 미국에 이은 세계 2위”라고 소개했다.
올 들어 중국 신약 라이선스 거래 증가세는 더 맹렬하다. 중국 화신증권 보고서에 따르면 올해 1분기 중국 신약 라이선스 거래액은 전년 같은 기간과 비교해 222% 급증했다. 특히 10억 달러 이상의 빅딜이 11건으로, 글로벌 전체의 거의 절반 가까이를 차지했다. 이 중 6건은 올해 글로벌 라이선스 거래액 ‘톱10’에도 이름을 올렸다.

中 세계 최초 개발 이중항체...‘제2의 키트루다’
중국 바이오 제약사가 특히 강점을 보이는 분야는 항암제다. 글로벌 의약품 시장조사기관 아이큐비아(IQVIA)에 따르면 지난해 말 중국 제약업계 기술 수출에서 항암제 비중은 54%에 달했다. 전 세계 항암제 임상시험 중 중국이 진행 중인 비율은 2009년 2%에서 지난해 39%로 급증해 이미 미국(32%)과 유럽(20%)도 제쳤다.
특히 중국 제약사 아케소가 지난해 개발한 세계 최초의 이중특이항체 후보물질 ‘이모네시맙’은 전 세계 의약품 판매 1위인 면역항암제 PD-1 치료제 '키트루다’를 능가할 수 있다는 평가도 받을 정도다.
이노네시맙의 개발은 빅파마(글로벌 대형 제약사)들이 중국 항암제를 비롯한 신약 개발에 주목하는 전환점이 됐다.
한 업계 관계자는 차이신을 통해 “이중항체 항암제를 사려는 빅파마들은 일단 중국 시장에 있나 없나부터 살펴볼 것"이라고 전했다. 독일 컨설팅업체 롤랜드버거의 리성 바이오제약 및 헬스서비스 책임자는 “중국 신약 파이프라인 규모가 방대해 '혁신약 슈퍼마켓'이라 불린다”며 “중국은 풍부한 과학기술 연구자원, 독특한 엔지니어 보너스, 방대한 환자군, 정책적 지원 등 신약 개발의 유리한 조건을 갖췄다”고 설명했다.
신약 심사 승인기간 30일 단축...규제완화 속도
미국 하버드대학교 벨퍼 과학국제문제센터가 얼마 전 주요 첨단기술 국가순위를 평가한 '핵심 및 신흥기술 지수' 보고서에 따르면 중국은 생명공학 분야에서 미국과의 격차를 빠르게 좁혀나가며 향후 미국을 추월해 1위를 할 가능성도 있는 것으로 나타났다.
최근 들어 중국 바이오 제약산업이 빠르게 발전한 데는 중국 정부의 정책적 지원이 한몫하고 있다는 분석이다. 바이오 제약은 중국의 첨단 제조업 발전 전략인 ’중국제조 2025’에 우주항공, 반도체, 로켓 등과 함께 10대 핵심 육성 산업으로 포함돼 중국 정부의 지원사격을 받았다.
중국은 신약 기술 개발이 속도를 낼 수 있도록 규제를 허물고 심사도 단축하고 있다. 최근 중국 국가약품감독관리총국(NMPA)은 주요 신약 임상시험계획(IND)에 대한 심사 기간을 현행 60일 이내에서 30일로 단축하기로 한 게 대표적이다. 신약 가치가 명확하거나 소아암·희귀질환 치료 목적의 소아용 약물, 다국가 임상시험 등이 단축 대상이다.
중국의 임상시험계획 심사는 과거 6개월에서 1년까지 걸리다가 2018년 60일로 크게 줄어든 데 이어 이번에 30일까지 줄인 것은 미국식품의약국(FDA)과 유사한 심사 형태를 채택해 임상 속도를 높이려는 의도다.
이는 중국 제약사들의 글로벌 대형 제약사(빅파마)와의 투자나 기술 거래에 더 긍정적인 영향을 미칠 것으로 보고 있다.
또 최근 ‘특허절벽’을 우려하는 빅파마들이 특허 만료 의약품을 대체할 신약 파이프라인을 물색하는 데다가, 중국 제약사의 라이선스가 상대적으로 저렴해 향후 이 같은 거래는 앞으로 계속 증가할 것이란 전망이다.
©'5개국어 글로벌 경제신문' 아주경제. 무단전재·재배포 금지



![[르포] 중력 6배에 짓눌려 기절 직전…전투기 조종사 비행환경 적응훈련(영상)](https://image.ajunews.com/content/image/2024/02/29/20240229181518601151_258_161.jpg)



