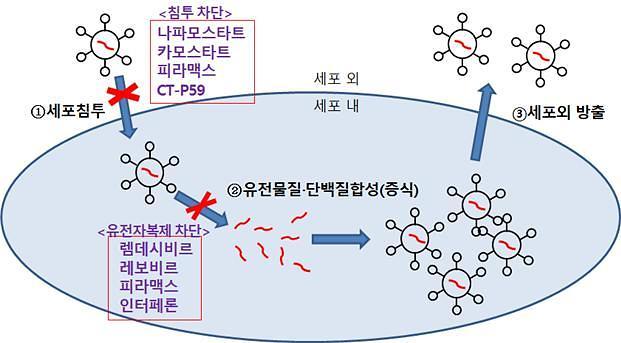
항바이러스제 작용 기전 모식도 [자료=식품의약품안전처 제공]
식약처에 따르면 지난 11일 기준 허가된 임상시험은 총 15건이었으나, 이날 식약처가 GC녹십자 혈장분획치료제 'GC5131’의 임상2상을 허가하면서 승인 건수가 1건 추가됐다. 현재까지 국내에서 승인된 코로나19 치료제‧백신 임상시험은 총 21건이지만, 이 중 5건은 현재 임상시험이 종료된 상태다.
이날 허가 받은 GC녹십자 혈장분획치료제 GC5131은 코로나19 완치자의 혈장을 이용해 개발 중인 ‘고면역글로불린(Hyper-immune Globulin)’ 성분 의약품이다. 혈장분획치료제는 코로나19 완치자의 혈액 중 혈장을 대량으로 수집한 후 여러 공정을 거쳐 제품화하는 것으로, 코로나19 중화항체(바이러스 무력화 항체)가 농축된 면역글로불린(혈장 성분 중 면역에 중요한 역할을 하는 단백질)을 이용한다.
이외에 현재 임상시험 중인 것은 고려대 구로병원이 실시하는 ‘알베스코흡입제’와 부광약품의 ‘레보비르’, 신풍제약 ‘피라맥스’, 종근당 ‘나파모스타트(후탄, CKD-314)’, 크리스탈지노믹스 ‘카모스타트(CG-CAM20)', 대웅제약 '카모스타트(DW1248)’, 셀트리온 ‘CT-P59’, 서울대병원 ‘인터페론(Rebif)’ ‘바리시티닙‘, 동아대병원 '페로딜정’, 경상대병원 '후탄(나파모스타트)', 엔지켐생명과학 ‘EC-18’, 제넥신 'GX-I7(인터루킨)' 등이 있다.
©'5개국어 글로벌 경제신문' 아주경제. 무단전재·재배포 금지



![[르포] 중력 6배에 짓눌려 기절 직전…전투기 조종사 비행환경 적응훈련(영상)](https://image.ajunews.com/content/image/2024/02/29/20240229181518601151_258_161.jpg)



