
동아에스티 관계사 메타비아는 비만치료제로 개발 중인 'DA-1726'의 추가 임상 1상에서 우수한 체중 감량 효과, 혈당 강하 및 간 경직도 감소 효과를 확인했다고 6일 밝혔다.
이번 임상은 비만이며 체질량지수가 30–45 kg/m²인 건강한 성인 9명을 대상으로 DA-1726 48mg 또는 위약을 4주·8주간 주 1회 투여하는 방식으로 진행됐다.
DA-1726 48mg 투여군에서는 치료의 중단없이 위장관계 부작용이 경증에서 증등도로 나타나 양호한 내약성을 확인했다. 4주째 평균 체중은 6.1%(6.6kg), 허리둘레는 5.8cm(2.3인치) 감소했으며, 8주째 평균 체중은 9.1%(9.6kg), 허리둘레는 9.8cm(3.8인치) 감소했다.
특히 투약 54일째 공복혈당은 105.3mg/dl에서 93mg/dl로 감소해 정상 범위로 들어왔으며, 당화혈색소(HbA1c)가 6.0%에서 5.5%로 감소되는 유의미한 혈당 강하 효과도 확인됐다. 간 경직도는 DA-1726 투여 후 54일째 기준치인 5.9 kPa 대비 23.7% 감소된 것으로 나타났다.
DA-1726은 옥신토모듈린 유사체 계열의 비만치료제로 개발 중인 신약 후보물질이다. 글루카곤 유사 펩타이드(GLP-1) 수용체와 글루카곤 수용체에 동시 작용해 식욕억제와 인슐린 분비 촉진, 말초에서 기초대사량을 증가시켜 체중 감소와 혈당 조절을 유도한다.
메타비아는 이번 추가 임상 1상을 통해 확인된 체중감량 효과와 내약성을 토대로, 단계적 증량 탐색을 위한 1단계는 DA-1726 48mg까지, 2단계는 64mg을 투약하는 총 16주간의 용량조절 임상 1상을 추가로 진행할 계획이다.
김형헌 메타비아 대표는 "이번 추가 임상 1상을 통해 우수한 체중 감량 효과를 재확인하고 혈당 강하, 간 경직도 감소 효과까지 확인하는 성과가 있었다"며 "이후 진행 16주간의 임상을 통해 차세대 비만치료제로서의 가능성과 경쟁력을 강화하겠다"고 말했다.
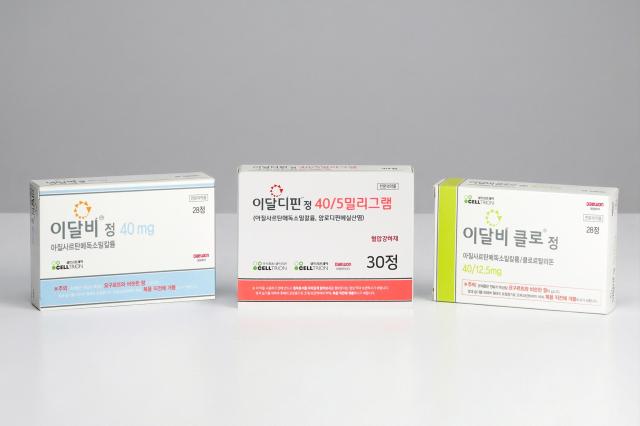
이번 계약에 따라 대원제약은 셀트리온제약의 고혈압 치료제 △이달비정(아질사르탄메독소밀칼륨) △이달비클로정(아질사르탄메독소밀칼륨·클로르탈리돈)과 더불어 이번에 새롭게 출시된 △이달디핀정(아질사르탄메독소밀칼륨·암로디핀베실산염)까지 총 3개 제품의 국내 판매를 공동으로 진행하게 된다.
이달비는 발사르탄과 올메사르탄 대비 우월한 혈압 강하 효과를 보이며, 하루 동안 효과가 얼마나 일정하게 유지되는지 의미하는 T/P Ratio가 우수해 낮은 혈압 변동성의 장점을 지닌 ARB(안지오텐신II 수용체 차단제) 계열의 고혈압 치료제다.
이달디핀은 강력한 혈압 강하 효과를 가진 아질사르탄메독소밀과, 칼슘 채널 차단제 'CCB' 계열인 암로디핀을 결합한 개량신약 복합제다.
대원제약 관계자는 "이달비 패밀리의 판권을 확보함으로써 순환기계 포트폴리오가 강화됐다"며 "기존 만성질환 치료제들을 대형 블록버스터로 성장시킨 노하우를 바탕으로 이달비 패밀리 입지를 확고히 할 것"이라고 밝혔다.

한국로슈진단은 지난 5일 기후에너지환경부 인가 비영리 공익법인 E-순환거버넌스와 ESG 경영 실천을 위한 업무협약(MOU)을 체결했다고 6일 밝혔다.
이번 협약은 한국로슈진단 사업장에서 발생하는 폐기 장비의 처리 전 과정을 자원순환 관점으로 전환해 환경 발자국을 줄이고 ESG 경영을 한층 강화하기 위해 마련됐다.
지속 가능성은 '환자가 내일 필요로 하는 것을 오늘 행하라'는 로슈그룹의 미션을 실현하기 위한 중요한 부분이다. 로슈그룹은 기후 변화 대응과 자원의 효율적 활용을 위해 환경 영향 지표인 에코밸런스(Eco-Balance) 개선과 2045년 넷제로(Net-Zero) 달성을 위한 중장기 목표를 추진하고 있다.
한국로슈진단은 진단업계 리딩기업으로서 사업장 운영 전 과정에서의 탄소 배출과 폐기물 발생을 줄이기 위한 다양한 방안을 모색해 왔다. 특히 장비 운용에서 불가피하게 발생하는 폐기 장비의 처리 방식을 개선하기 위해 이번 자원순환 프로그램을 도입했다.
아울러 온실가스 감축 확인서, 순환자원 생산 기여 확인서, 사회공헌 활동 확인서 등을 발급 받아 자원순환 성과와 ESG 경영 활동을 객관적으로 확인, 관리할 수 있게 된다.
킷 탕 한국로슈진단 대표이사는 "폐기 장비를 자원으로 순환시키는 체계를 구축함으로써 환자들이 더 건강한 환경에서 치료받을 수 있는 지속가능한 헬스케어 생태계 조성에 앞장설 것"이라고 밝혔다.

에이비엘바이오는 오는 19일(현지시간)부터 미국에서 해외 NDR(Non-Deal Roadshow)을 진행한다고 6일 밝혔다. 이번 NDR을 통해 해외 기관 투자자들을 만나 자사의 이중항체 기술력과 파이프라인 개발 현황, 향후 사업 전략 등을 소개할 계획이다. 해외 투자자들과의 신뢰를 강화하고, 해외 자금 유입을 통해 주주가치를 제고한다는 방침이다.
에이비엘바이오는 ABL001(Tovecimig)을 비롯해 BBB(Blood-Brain Barrier) 셔틀 플랫폼 그랩바디-B(Grabody-B), 4-1BB 기반 이중항체 플랫폼 그랩바디-T(Grabody-T), 차세대 ADC 등 네 가지 핵심 분야를 중심으로 회사의 사업을 소개하고 있다.
ABL001은 에이비엘바이오가 개발해 미국 바이오 기업 컴퍼스 테라퓨틱스에 기술이전한 DLL4 및 VEGF-A 표적 이중항체로, 현재 담도암 2차 치료제로 임상 2/3상이 진행되고 있다.
그랩바디-B는 IGF1R을 표적해 약물의 전달 효율을 높여주는 셔틀 기술이다. 에이비엘바이오는 지난해 4월 글로벌 제약사 GSK와 21억 4010만 파운드(약 4조 1000억원) 규모의 그랩바디-B 기술이전을 체결한데 이어, 같은 해 11월 일라이 릴리와 26억 200만 달러(약 3조 8천억원) 규모의 그랩바디 기술이전과 1500만 달러(약 220억원) 규모의 전략적 지분 투자 계약을 체결했다.
그랩바디-T는 암 세포가 발현된 종양 미세환경에서 T 세포를 활성화하는 이중항체 면역항암제를 개발하는데 활용된다. 에이비엘바이오는 이중항체 ADC, 듀얼 페이로드 ADC 등 차세대 ADC 개발을 진행하고 있다. 최근 이중항체 ADC 후보물질인 ABL206의 미국 임상 1상을 위한 임상시험계획서(IND)를 미국 식품의약국(FDA)에 제출했으며, ABL209의 임상 1상 IND도 준비 중이다.
이상훈 에이비엘바이오 대표는 "미국 NDR을 시작으로 홍콩과 싱가포르 등 주요 국가에 대한 NDR도 고려 중"이라며 "앞으로도 회사의 기술을 널리 알리고 글로벌 바이오 기업으로의 도약을 위해 최선을 다하겠다"고 말했다.
©'5개국어 글로벌 경제신문' 아주경제. 무단전재·재배포 금지


![[르포] 중력 6배에 짓눌려 기절 직전…전투기 조종사 비행환경 적응훈련(영상)](https://image.ajunews.com/content/image/2024/02/29/20240229181518601151_258_161.jpg)



